研究成果詳細
病原性大腸菌治療薬の開発につながる感染分子メカニズムを発見
要約
本学統合研究院の半田宏教授と飯泉陽介博士課程3年は,東京大学医科学研究所の笹川千尋教授との共同研究により,ナノアフィニティービーズ技術を用いてO157に代表される病原性大腸菌の感染分子メカニズムを解明した.このメカニズムの発見は,将来診断・治療薬の開発につながるものである.本研究成果は「The enteropathogenic E. coli effector EspB facilitates microvilli effacing and antiphagocytosis by inhibiting myosin function」という表題で,Cell Pressから出版されている感染症分野で世界トップの科学論文誌「Cell Host & Microbe」に掲載される研究の内容,背景,意義,今後の展開等
本学統合研究院の半田宏教授と飯泉陽介博士課程3年は,東京大学医科学研究所の笹川千尋教授との共同研究により,ナノアフィニティービーズ技術を用いて O157に代表される病原性大腸菌の感染分子メカニズムを解明した.このメカニズムの発見は,将来診断・治療薬の開発につながるものである.本研究成果は 「The enteropathogenic E. coli effector EspB facilitates microvilli effacing and antiphagocytosis by inhibiting myosin function」という表題で,Cell Pressから出版されている感染症分野で世界トップの科学論文誌「Cell Host & Microbe」に掲載される.
O157に代表される病原性大腸菌は,重大な食中毒の原因菌であり,現在でも乳幼児,高齢者を中心に毎年死者を出している.しかし,病原性大腸菌がいかなる分子メカニズムで腸管組織に感染して,いかに宿主免疫から逃れて,増殖するかについては,未だ不明であった.
今回,半田宏教授らのグループは,長年病原性大腸菌0157の研究を続けてきた東京大学医科学研究所の笹川千尋教授と共同研究を開始して,特に,病原性大 腸菌ゲノム上にコードされているEspB遺伝子に注目し,その遺伝子産物であるEspBタンパク質の働きを分子レベルで追求した.というのは,EspBは 病原性大腸菌の感染に必須な因子として知られていたが,どのような機能を持っているかほとんどわかっていなかったからだ.
そこで,半田宏教授らのグループが開発した革新的なナノアフィニティー微粒子に,タッグ付きの組換えEspBをそのタッグを介してビーズ表面に化学結合し,このEspB固定化ビーズを用いてヒト細胞内にあるEspBの標的タンパク質の探索・同定を行った.
その結果,EspBが,ヒト細胞の動きや筋肉の運動に関わるミオシンタンパク質のスーパーファミリーに選択的に結合することが明らかになった.
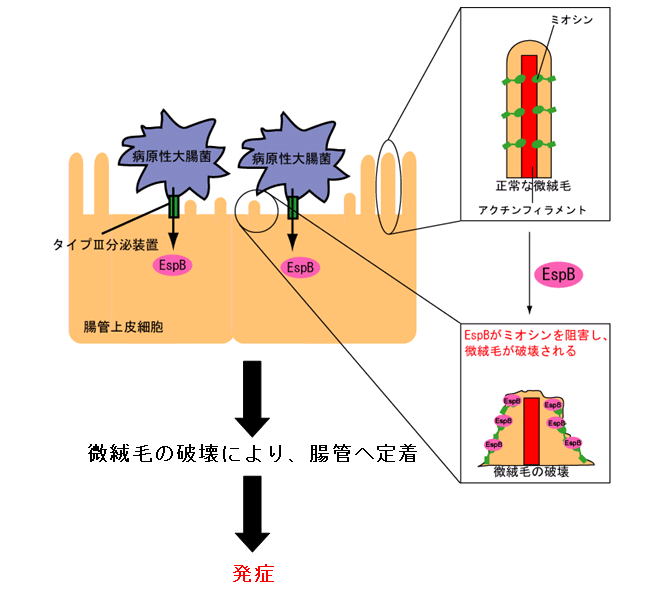
その後,分子レベル・細胞レベルでの綿密な解析を行い,EspBがミオシンタンパク質と特異的に結合し,通常起こっているミオシンとアクチンとの間の結合 を阻害することを明らかにした.ミオシンとアクチンとの結合は,腸管上皮細胞の微絨毛形成・維持や,重要な免疫担当細胞であるマクロファージの貪食作用に も必須であるが,EspBによる阻害により,腸管上皮細胞では微絨毛が破壊され,マクロファージでは貪食作用が抑制されることを示し,その結果,病原性大 腸菌の腸管上皮細胞への感染が成立し,さらに免疫反応が抑制されることを明らかにした.
さらに、EspBの野生型や変異型を発現する病原性大腸菌を用いて,実験マウスへの感染実験を行い,病原性大腸菌のマウス個体レベルにおける感染の成立に実際に重要であることが証明された.
本研究により,長年未解明であった病原性大腸菌の感染により引き起こされる重大な現象である「腸管上皮の微絨毛の破壊」と「マクロファ-ジの貪食作用の抑 制」の分子メカニズムに加えて,新たな宿主と細菌の相互作用メカニズムが解き明かされた.さらに本成果は,病原性大腸菌に対する診断薬や治療薬の開発にお いて有用な知見・情報になると期待される.
 |
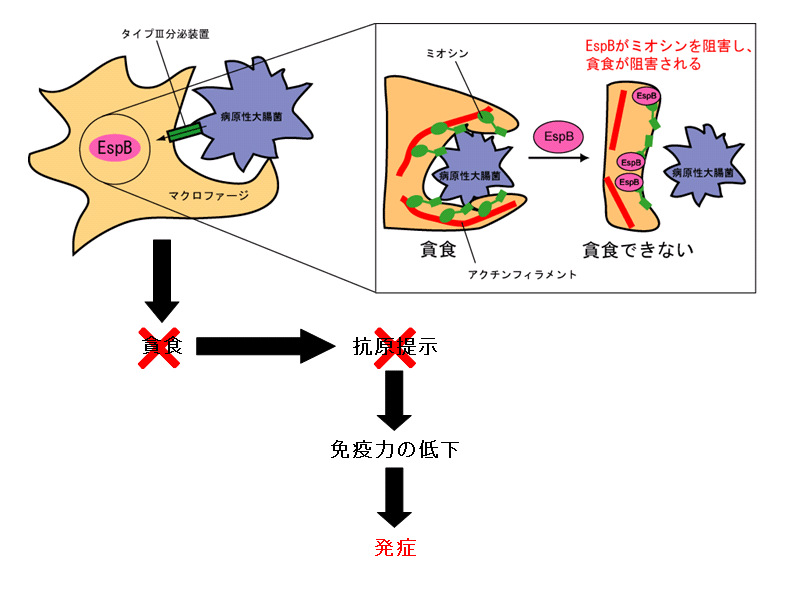 |
| 病原性大腸菌が引き起こす微絨毛の破壊の分子メカニズム | 病原性大腸菌が引き起こす貪食の抑制の分子メカニズム |
| 本件に関するお問い合せ先 |
|
|---|---|
| TEL | |
| FAX | |
| URL | http://www.handa.bio.titech.ac.jp/ |
*6年以上前の研究成果は検索してください
