研究成果詳細
ヘム生合成に関わるヘム前駆体のミトコンドリア集積機構の解析
要約
本学統合研究院の半田宏教授と東基記博士課程3年は,慶應義塾大学医学部の加部泰明講師(2008年3月まで当研究室助教)との共同研究により,ナノアフィニティービーズ技術を用いて,ヘム生合成に関わるヘム前駆体のミトコンドリア集積機構を解明した.本研究により,ヘム生合成に関わる新規酵素としてAdenine nucleotide translocator(ANT)を同定した.本研究成果は 「Adenine nucleotide translocator transports haem precursors into mitochondria.」という表題で,「PLoS ONE」の8月27日号に掲載されている.研究の内容,背景,意義,今後の展開等
本学統合研究院の半田宏教授と東基記博士課程3年は,慶應義塾大学医学部の加部泰明講師(2008年3月まで当研究室助教)との共同研究により,ナノア フィニティービーズ技術を用いて,ヘム生合成に関わるヘム前駆体のミトコンドリア集積機構を解明した.本研究により,ヘム生合成に関わる新規酵素として Adenine nucleotide translocator(ANT)を同定した.本研究成果は 「Adenine nucleotide translocator transports haem precursors into mitochondria.」という表題で,「PLoS ONE」の8月27日号に掲載されている.
ヘムはテトラピロール環を持つポルフイリン誘導体であり,電子伝達や酸化還元など生命現象に 関わるヘムタンパク質の補酵素である.ヘムが酵母や赤パンカビなどの菌類から植物や人にいたるまで進化的に幅広く保存されていることからも,ヘムの重要性 が示唆される.ヘム生合成には細胞質またはミトコンドリアに存在する8種類の酵素が関わっている.ヘム生合成の最後の酵素である Ferrochelatase(FECH)はミトコンドリアのマトリックス内に存在する.このため,FECHの基質であるProtporphyrin IX(PP IX)はミトコンドリア内膜を透過し,マトリックス内に蓄積する必要がある.しかし、PP IXのマトリックス内への蓄積を行う因子は明らかとなっていなかった.
当グループは,PP IXのマトリックス内への蓄積を行う因子を明らかとするために,ラット肝臓ミトコンドリア抽出液よりヘムおよびPP IXに結合する因子をアフィニティー精製によって探索した.アフィニティー精製には,当グループが開発した革新的なナノアフィニティー微粒子を担体として 用い,ナノアフィニティー微粒子表面のアミノ基にヘムまたはPP IXのカルボキシル基を化学結合したヘムまたはPP IX固定化ビーズを用いた.本ナノアフィニティー微粒子は非特異吸着が少なく,比表面積が大きいため、アフィニティー精製の担体として非常に優れている. 本研究後も慶應義塾大学医学部の末松誠教授・加部泰明講師らのグループとの共同研究は続いており,現在はお互いの強みであるアフィニティー精製とガスセン サーの技術を用いて新たにERATOプロジェクトが立ち上がっている.
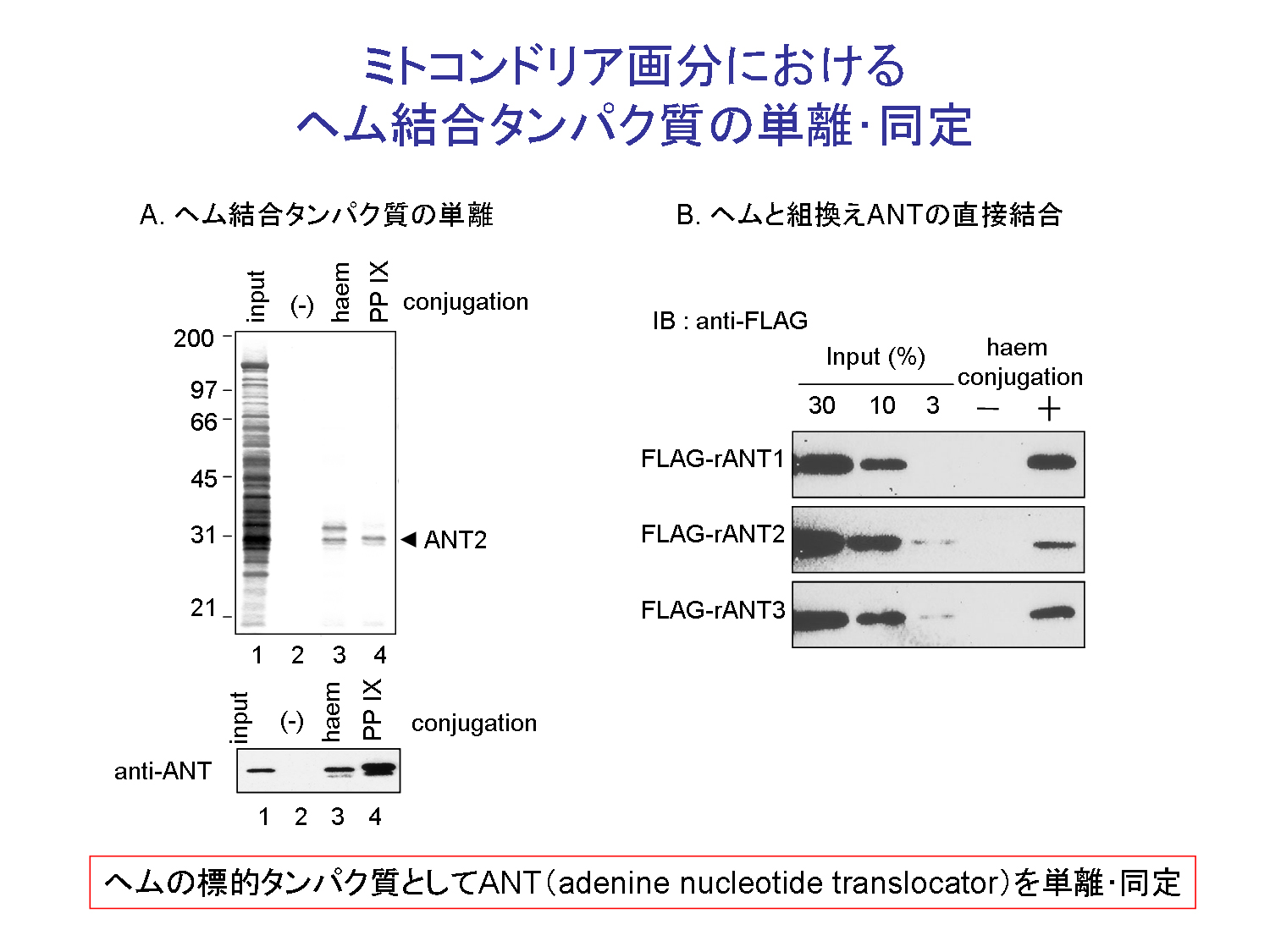
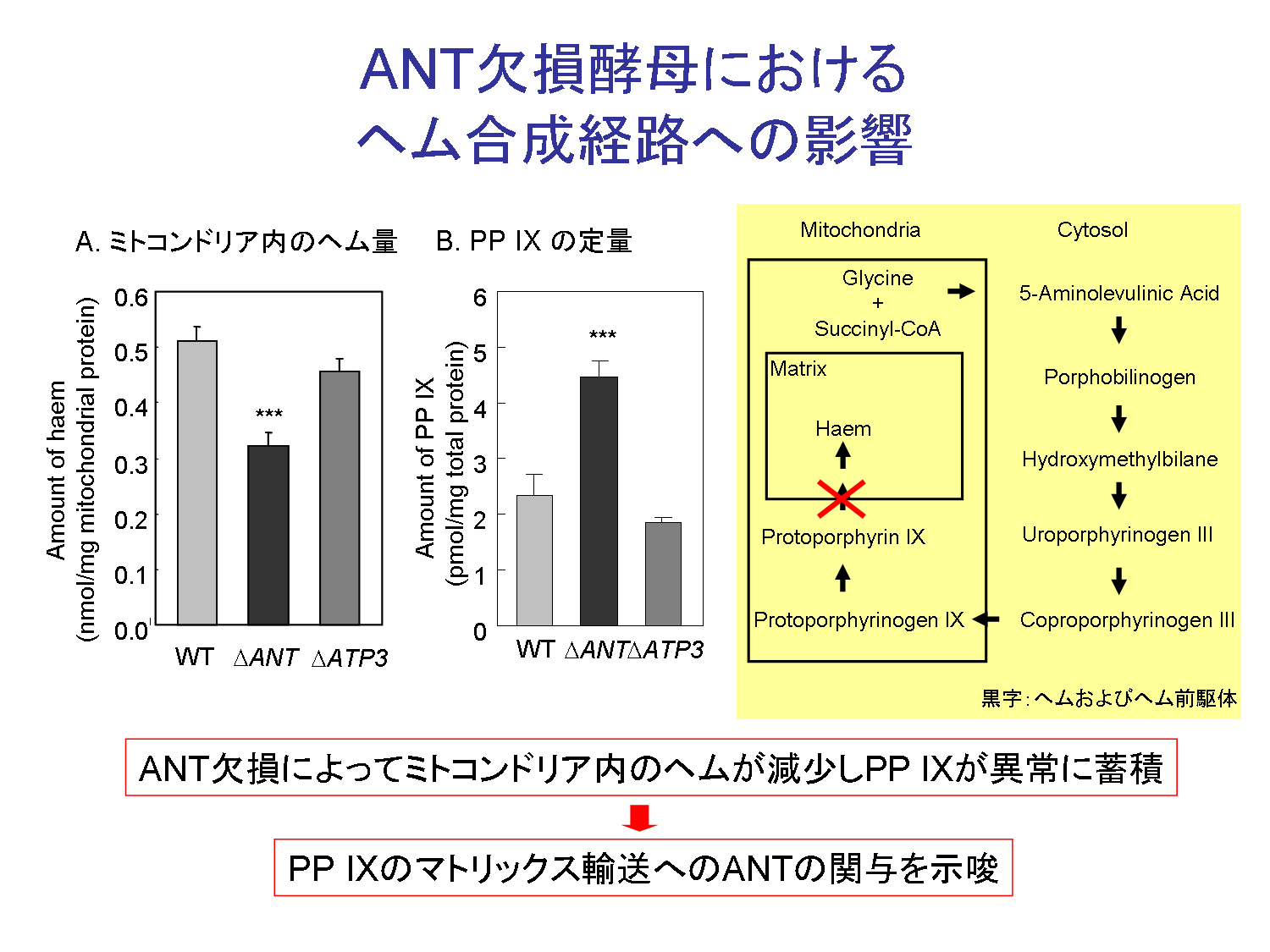
我々は,ラット肝臓ミトコンドリア抽出液からアフィニティー精製 によって,ヘムおよびPP IXの結合因子としてANTの精製・同定に成功した(図1).ANTはミトコンドリア内膜に存在し,マトリックス内のATPと細胞質のADPの交換反応を 行っている.次に,in vitroの解析から,ヘムおよびヘム前駆体がANTの基質であるADPと競合的にミトコンドリアのマトリックスへ集積されることを明らかとした.さら に,酵母を用いた解析から,ANT欠損酵母においてミトコンドリア内のヘム量の減少およびヘム前駆体の蓄積が引き起こされることも明らかとした.本研究に より,酵母においてANTを介したヘム前駆体のミトコンドリア集積がヘム生合成において重要な働きをすることが示唆された(図2).
本研究は,長年未解明であったPP IXのマトリックス内の蓄積にANTが関与する事を明らかとし(図3),生命科学に大いに貢献するものである.本成果は,ヘム研究において有用な知見・情報になると期待される.
 |
 |
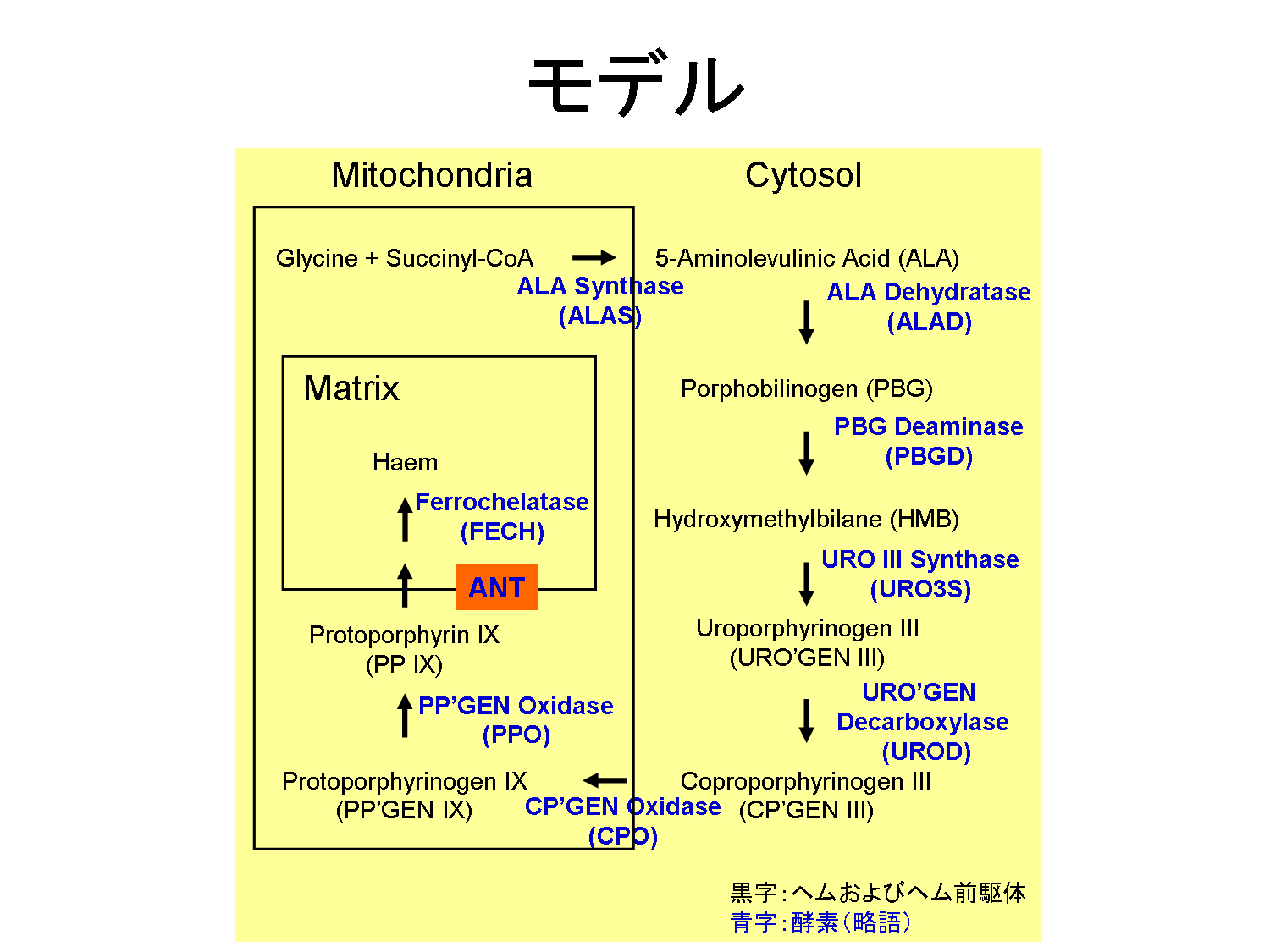 |
| 図1,ヘム結合因子の同定 | 図2,ANT欠損酵母におけるヘム合成経路への影響 | 図3,本研究によって示唆されるモデル |
| 本件に関するお問い合せ先 |
|
|---|---|
| TEL | |
| FAX | |
| URL | http://www.handa.bio.titech.ac.jp/ |
*6年以上前の研究成果は検索してください
